醫(yī)院倫理委員會(huì)
醫(yī)院倫理委員會(huì)
初始審查標(biāo)準(zhǔn)操作規(guī)程
1. 目的
為使倫理委員會(huì)初始審查的受理、處理、審查、傳達(dá)決定、文件存檔等工作有章可循,特制定本規(guī)程,以從程序上保證初始審查工作的質(zhì)量。
2. 范圍
本SOP適用于倫理委員會(huì)對(duì)初始審查申請(qǐng)所進(jìn)行的審查。
3. 職責(zé)
3.1 倫理委員會(huì)秘書(shū)
3.1.1 受理送審材料。
3.1.2 處理送審材料。
3.1.3 為委員審查工作提供服務(wù)。
3.1.4 傳達(dá)決定。
3.1.5 文件存檔。
3.2 主審委員
3.2.1 會(huì)前審查主審項(xiàng)目的送審文件,填寫(xiě)主審工作表。
3.2.2會(huì)議審查作為主要發(fā)言者,提問(wèn)和發(fā)表審查意見(jiàn)。
3.3 獨(dú)立顧問(wèn)
3.3.1會(huì)前審查咨詢(xún)項(xiàng)目的送審文件,填寫(xiě)咨詢(xún)工作表。
3.3.2受邀參加審查會(huì)議,陳述意見(jiàn)。
3.4 委員
3.4.1參加審查會(huì)議,審查每一項(xiàng)目,提問(wèn)和發(fā)表審查意見(jiàn)。
3.4.2以投票方式做出審查決定。
3.5 副主任委員
3.5.1經(jīng)主任委員授權(quán)后可審簽會(huì)議記錄;
3.5.2經(jīng)主任委員授權(quán)后可審核、批準(zhǔn)、簽發(fā)審查決定文件。
3.5 主任委員
3.5.1主持審查會(huì)議。
3.5.2審簽會(huì)議記錄。
3.5.3批準(zhǔn)、簽發(fā)審查決定文件。
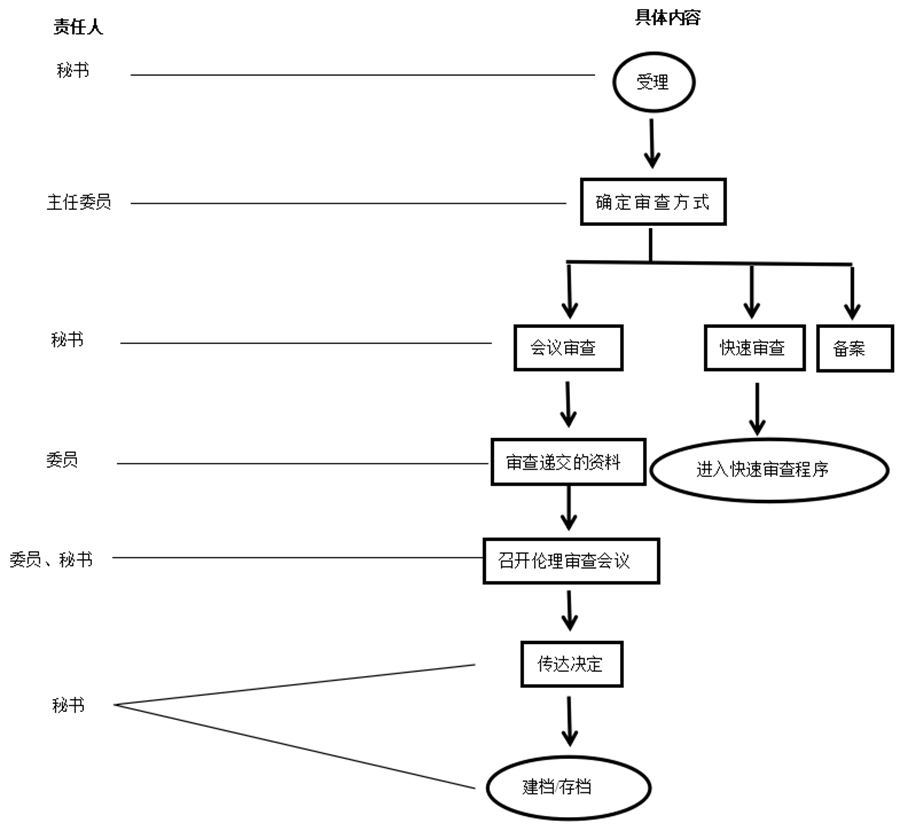
4. 流程圖
見(jiàn)附件1。
5. 審核程序
5.1 受理
5.1.1倫理秘書(shū)接收送審文件時(shí),對(duì)其完整性(初始審查申請(qǐng),臨床研究方案,知情同意書(shū),招募受試者的材料,病例報(bào)告表,研究者手冊(cè),其它)和規(guī)范性(初始審查申請(qǐng)表填寫(xiě)完整,項(xiàng)目負(fù)責(zé)人(或委托人)簽名并注明日期,其它)進(jìn)行形式審查。
5.1.2 如審核資料符合倫理要求,秘書(shū)5個(gè)工作日內(nèi)出具受理通知,進(jìn)入處理程序。
5.1.3如審核資料不符合要求,需修改、補(bǔ)充的,秘書(shū)5個(gè)工作日內(nèi)出具修改、補(bǔ)充通知。
5.1.4 修改、補(bǔ)充后受理以及送審文件管理,參照研究項(xiàng)目的受理執(zhí)行。
5.2 處理
5.2.1 決定審查方式
5.2.1.1 首次提交倫理審查的臨床試驗(yàn)研究項(xiàng)目,一般應(yīng)采用會(huì)議審查方式。
5.2.1.2 以下情況可以采用快速審查:①有限的研究步驟下,研究風(fēng)險(xiǎn)不大于最小風(fēng)險(xiǎn),不涉及弱勢(shì)群體和個(gè)人隱私及敏感性問(wèn)題。②兩名主審委員的審查意見(jiàn)一致,且都為“同意”或“同意研究繼續(xù)進(jìn)行”等肯定性意見(jiàn)。③科研項(xiàng)目申報(bào)的倫理審查。④其它倫理委員會(huì)認(rèn)為可以采用快速審查的情況。
5.2.1.3 以下情況可以采用備案:①不涉及人類(lèi)遺傳資源信息的回顧性調(diào)查分析研究。②無(wú)研究風(fēng)險(xiǎn)或研究風(fēng)險(xiǎn)很小。③其它倫理委員會(huì)認(rèn)為可以采用備案的情況。
5.2.1.4 快速審查意見(jiàn)有“必要的修改后同意”,“不同意”,“終止或者暫停已同意的研究”,或兩名主審委員的審查意見(jiàn)不一致,該項(xiàng)目則轉(zhuǎn)為會(huì)議審查的方式。
5.2.2 審查的準(zhǔn)備
5.2.2.1選擇主審委員:每個(gè)項(xiàng)目選擇2名以上主審委員;優(yōu)先選擇醫(yī)藥專(zhuān)業(yè)背景委員主審研究方案;優(yōu)先選擇非醫(yī)藥專(zhuān)業(yè)背景委員主審知情同意書(shū)。
5.2.2.2 準(zhǔn)備審查文件:送審文件的完整性和規(guī)范性符合要求后,倫理秘書(shū)為主審委員準(zhǔn)備主審項(xiàng)目的整套送審文件,準(zhǔn)備相應(yīng)的審查工作表。
5.2.2.3 獨(dú)立顧問(wèn)的選擇(如有):主要基于需要咨詢(xún)的審查問(wèn)題與候選人專(zhuān)業(yè)領(lǐng)域與社會(huì)文件背景相符的考慮,一般選擇1-2名獨(dú)立顧問(wèn)。
5.2.2.4 準(zhǔn)備咨詢(xún)文件:為獨(dú)立顧問(wèn)準(zhǔn)備咨詢(xún)項(xiàng)目的相關(guān)送審文件,以及相應(yīng)咨詢(xún)工作表。
5.2.2.5會(huì)議審查安排,會(huì)議報(bào)告的安排,參照研究項(xiàng)目的處理執(zhí)行。
5.3 審查
5.3.1 審查程序
5.3.1.1 會(huì)議審查:參照《會(huì)議審查標(biāo)準(zhǔn)操作規(guī)程執(zhí)行》。
5.3.1.2 快速審查,參照《快速審查標(biāo)準(zhǔn)操作規(guī)程》執(zhí)行。
5.3.2 審查項(xiàng)目
? 研究的設(shè)計(jì)與實(shí)施是否科學(xué):□是,□否,□其它
? 研究的風(fēng)險(xiǎn)與受益比是否合適:□是,□否,□其它
? 受試者的招募過(guò)程是否合理:□是,□否,□其它
? 知情同意書(shū)的書(shū)寫(xiě)是否合適:□是,□否,□其它
? 受試者的醫(yī)療和保護(hù)是否充分:□是,□否,□其它
? 特殊疾病人群、特定地區(qū)人群、族群和弱勢(shì)群體的考慮是否充分:□是,□否,□其它
5.3.3 主審委員填寫(xiě)初始審查工作表(見(jiàn)附件2),獨(dú)立顧問(wèn)(如有)填寫(xiě)咨詢(xún)工作表(見(jiàn)附件3)。
5.3.4倫理秘書(shū)匯總主審委員意見(jiàn),提交主任委員或副主任委員(經(jīng)主任委員授權(quán)后)審核。
5.3.5 主任委員或副主任委員(經(jīng)主任委員授權(quán)后)批準(zhǔn)、簽發(fā)決定文件。
5.3.5.1 決定是否同意開(kāi)展研究(同意,作必要修改后同意,作必要修改后重審,不同意)。
5.3.5.2 決定跟蹤審查的頻率(根據(jù)研究風(fēng)險(xiǎn)大小等情況,決定跟蹤審查的頻率),最長(zhǎng)不超過(guò)12個(gè)月。
5.3.5.3 快速審查是否更改審查的方式:提交會(huì)議審查。
5.4 傳達(dá)決定
5.4.1 制作:
5.4.1.1制作決定文件(一式三份):一般按項(xiàng)目委托方1份、研究單位2份;或根據(jù)申辦者的要求;
5.4.1.2 制作會(huì)議簽到表副本:初始審查、修改案審查以及(初始審查、修改案審查之后的)復(fù)審的決定,如果采用會(huì)議審查方式,需附“會(huì)議簽到表”副本;
5.4.2 蓋章:決定文件加蓋倫理委員會(huì)章。
5.4.3 傳達(dá)
5.4.3.1通知申辦方領(lǐng)取決定文件;
5.4.3.2 傳達(dá)時(shí)限:在審查決定后5個(gè)工作日內(nèi)完成決定的傳達(dá)。
5.5 文件存檔
5.5.1審查過(guò)程中形成、積累、保存的文件,按審查階段及時(shí)歸檔。
5.5.2會(huì)議審查的項(xiàng)目存檔文件:項(xiàng)目送審文件,初始審查工作表,會(huì)議簽到表,倫理費(fèi)發(fā)放表,會(huì)議投票單,會(huì)議記錄本,會(huì)議審查決定文件。
5.5.3快速審查項(xiàng)目中存檔文件:
藥物或器械臨床試驗(yàn)項(xiàng)目:送審文件,主審審查工作表,倫理審查決定文件。
新業(yè)務(wù)新技術(shù)、臨床科研類(lèi)項(xiàng)目:送審文件,倫理審查決定文件。
參考依據(jù):
《世界醫(yī)學(xué)大會(huì)赫爾辛基宣言》
ICH指導(dǎo)原則
《涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法》(2023年)
《倫理委員會(huì)制度與操作規(guī)程》(2021年)
《藥物臨床試驗(yàn)倫理審查工作指導(dǎo)原則》(2010年)
《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(2020年版)》
《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》(2022年)
附件1: